Chemistry of Life
結構生物體的分子,通常由不同種類的原子透過化學鍵來結合而成。原子間可能會產生各種形式的化學鍵,例如共價鍵、極性共價鍵、氫鍵等,這些鍵會穩定蛋白質與 DNA 架構,和影響各種化學反應平衡。
Elements and Atoms
- Matter
- 所有能在空間中看的見、擁有量的物質
- 由更小的 Elements 組合而成
- Element
- 不能夠再拆解成不同的物質時,就稱作元素
- e.g., Gold, Carbon
- 不能夠再拆解成不同的物質時,就稱作元素
- Atom
- 將元素拆拆拆,拆成最小單位並且依然保留該元素的 properties 就稱作原子
- e.g., Gold => Gold atoms
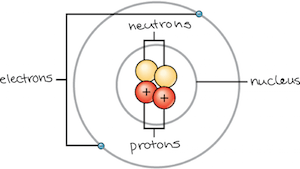
Atom
- Atom 可以稱成兩個 region,分為 atomic nucleus 和 orbitals ("clouds")
- Atomic nucleus 包含了 Proton 和 Neutron
- Proton (質子) 帶有 positive charge (正極)
- Neutron (中子) 則是中性
- Orbital 裡有 Electron
- 可以想像 electron 像 orbit 一樣圍繞 nucleus,但其實他是在周圍任何地方機率性的出現,並且跟 proton 吸引
- Electron (電子) 帶有 negative charge (負極)
- 一般的 atom 都會有這三種 subatomic particles
- 例如 Helium 有 2 個 Proton, 2 個 neutron 和 2 個 electron
- 只有 Hydrogen 是例外,他只有一個 Proton + 一個 Electron,而沒有 Neutron
- Proton 和 Neutron 有差不多的質量,為 克重
- 會用 atomic mass unit (amu) 這個單位來表示,一個 proton 為 1 amu 重
- Electron 則是只有 1/1800 amu 所以通常在表示 atom 重量時會被省略
- 一個 Neutral atom 表示他的 proton 和 electron 數量相等,正負極互相抵消
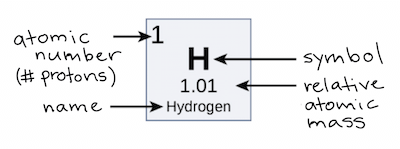
Atomic Number
- 一個 atom 是什麼元素,可以從他的 proton 數量來判斷
- e.g., Carbon atom 有 6 個 proton
- 我們稱這個數量為 atomic number
- 相同元素的 atom 可以有不同的 neutron
- 同個元素但不同 neutron 我們稱作 isotopes
- e.g., Carbon-12 和 Carbon-14
- Proton 和 Neutron 相加的質量稱作 Mass number
- Mass number = protons + neutrons
- e.g., Carbon-12 = 6 protons + 6 neutrons
- e.g., Carbon-14 = 6 protons + 8 neutrons
Atomic Mass
- 所以用 amu 來表達 mass number 就是 atomic mass
- e.g., Carbon-12 = atomic mass of 12 amu.
- 因為一種元素可以有多種 isotopes
- 但 carbon-12 在地球上出現的數量比 carbon-14 還要多非常多
- 所以科學家用 relative atomic mass 來表達一個 atom 在地球上的平均質量
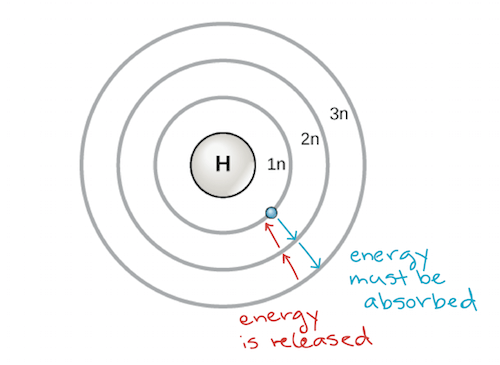
Electron shells and the Bohr model
- 科學家發現 electron 會根據不同的 energy level 在不同距離環繞 nucleus
- 一般來說可以分成 1n, 2n, 3n 三層
- 越內層的能量越小,越外層能量越大
- 所以下圖顯示當 electron 吸收能量時會跳到外層,而釋放能量時會跳到內層
- Atom 傾向保持在 lowest-energy 的 stable 狀態
- 所以 electrons 會從最內層的 low energy shell 開始填滿
- 1n 可以保存 2 electrons
- 2n 可以保存 8 electrons
- 3n 可以保存 18 electrons
- 而最外層的 shell 決定了每一種 atom 的 reactivity, 或是和其他元素結合的 tendency
- 最外層稱作 Valence shell,而在該層的 electron 稱作 Valence electrons
- 在 Biology 常見的元素,通常最外層都需要 8 electrons 來維持 stable
- 這個 Rule 稱為 Octet rule
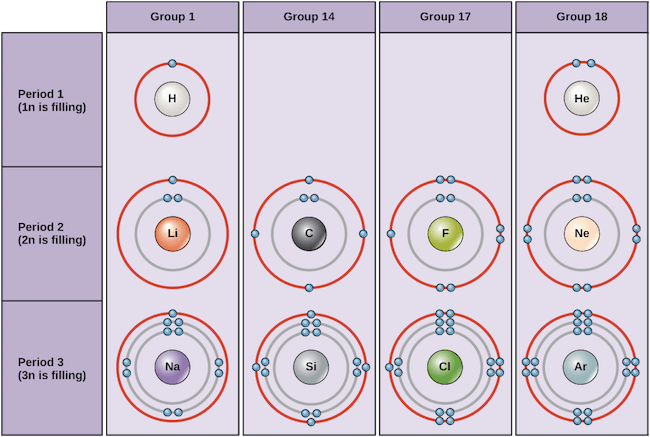
- 上圖可以看到一些常見的 electron configurations
- Helium (He) 有著 full valence shell (2 electrons in 1n)
- 所以他非常穩定不太和他人往來
- Neon (Ne) 一樣有 complete outer 2n shell 包含 8 electrons
- 所以可以看到 Group 18 (Noble gases) 都不太和其他元素反應
- Argon (Ar) 雖然在 3n 沒有包含滿滿的 18 electrons
- 但根據 octet rule 他和 Helium, Neon 一樣 stable
- 另外 Sodium (Na) 在 3n 只有 1 個 electron
- 所以他非常想要把這個 electron 給別人,讓自己穩定
- 而 Chlorine (Cl) 在 3n 則有 7 個 electrons
- 所以他和 sodium 非常 reactive,迫不及待從 sodium 手上拿到 electron
The periodic table

- 元素根據 atomic number (how many protons they have) 排列在週期表上
- 若都假設元素是 neutral atom 那就可以快速得到 electrons 的數目
- 又因為 columns, rows 我們可以從表中得到很多有用資訊
- Rows : Periods
- H 和 HE 的 electron 都要 fill 1n shell
- Li fill 2n shell
- Na fill 3n shell
- Columns : Groups of elements
- Group 1 只有 1 valence electron
- Group 18 則有 8 valence electrons 除了 HE
- Group 18 稱作 Noble (inert) gases,作為單個 atom 就已經 highly stable
- Group 1 除了 H 稱作 Alkali metals,只有 1 個 electron 在最外層所以 unstable
- 通常會 lose 或 share 他們的 valence electron 來達到 stable
- e.g.,
- e.g.,
- Group 17 稱作 Halogens,有 7 個 valence electrons 缺 1 所以 unstable
- 通常會從別的 atom 獲得 1 個 electron 來達到 stable
- e.g.,
- Carbon 在 Group 14 只有 4 valence electrons
- 通常 C 會藉由 share electrons 來達到 complete valence shell
- Forming bonds with multiple other atoms
Subshells and orbitals
- 為了更精確的表達 electrons 在 nucleus 周圍,也就是 electron orbitals 的分布
- 科學家用數學方法定義了 electrons 90% 所在的地方
- 這些 high-probability region 就是 orbital,每個可以容納 2 個 electrons
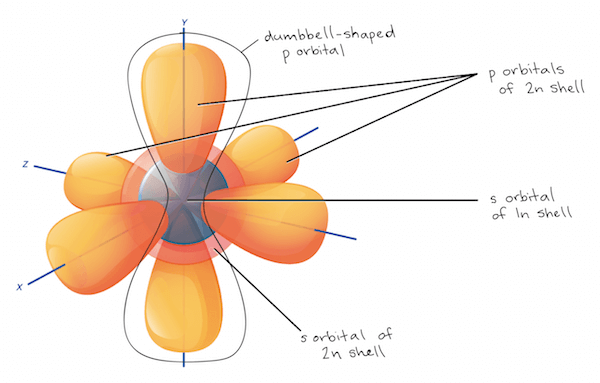
- 於是一個 electron shell 被分成多個 subshells,也就是 orbital sets
- Subshell 可以被指定為 s, p, d, f 代表不同形狀
- s 是 1 個 single, spherical orbital
- p 是 3 個 dumbbell-shape orbitals 各別垂直
- Biology 通常常見的就是 s, p subshells
- d, f 則是更複雜的形狀
Electron Shell with subshells
- 1n 通常對應於單個 1s orbital
- 所以 H 只有一個 electron 在 1s
- 這可以表達成 electron configuration as
- Superscript 表示有幾個 electron
- Helium 有兩個 electron 填滿 1s
- 所以可以表達為
- 所以 H 只有一個 electron 在 1s
- 2n 則對應有單個 2s 和三個 2p,每個包含 2 electrons
- 所以 electron 會先去 2s 再去 2p
- 例如 Li 有 3 個 electrons,會先填滿 1s 剩下一個再去 2s
- 再例如 Ne 是含有 10 electrons 的 Nobal gases
- 3n 一樣有單個 s orbital 和三個 p orbital (3s + 3*3p)
- 另外還會有一個 d orbital 但他的 energy 比 3s, 3p 還要多更多
- 通常要到 4 row 以上的元素才有可能滿足
- 所以第 3 row 的元素 (如 argon) 在 3s, 3p 都被填滿情況就可以說是 stable
Chemical bonds
- 為什麼元素會互相有化學鍵反應 ?
- 因為 atoms 皆想要得到最 stable 的狀態
- valence shell 被填滿
- 或是滿足 octet rule (8 valence electrons)
- 因為 atoms 皆想要得到最 stable 的狀態
Ions
- 一些 atom 在 gain/lose electron 後會變成 ions (charged particles)
- Ion 又可分成 cation (陽離子) 和 anion (負離子)
- Cation 是 positive ion 透過失去 electron 而來
- sodium => sodium cation
- Anion 是 negative ion 透過獲得 electron 而來
- 通常命名結尾 "-ide"
- chlorine anion is called chloride
- Cation 是 positive ion 透過失去 electron 而來
- 兩個 atoms 互相 lose/gain 的過程稱作 electron transfer
- Sodium atom + Chlorine atom
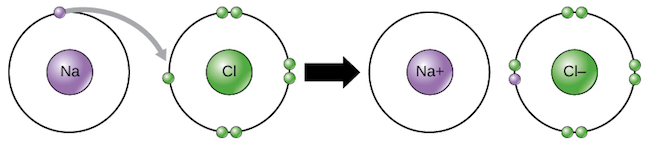
- Na 和 Cl 互相作用後,皆成為 ion,且滿足 octet rule 和 complete outermost shell
- 分別帶有 +1 charge 和 -1 charge
- 作用中的 lose/gain 通常會同時發生
Ionic Bond
- Ionic bond 指的是兩種相反 charge 的結合
- 例如 positively charged sodium ions + negatively charged chloride ions = sodium chloride (table salt)
- 這類的 ionic compounds 不只是單個和單個 ion 間的結合,而是大量 ions 排列組合而成
Covalent Bond
- 除了 lose/gain 的模式,atom 之間還可以透過 share electron 方式來達到 stable
- 這種方式就稱作 covalent bonds
- covalent bonds 在生物的分子間較 ionic bonds 常見
- 例如他是 carbon-based organic molecules (DNA, proteins) 架構的 key
- 我們拿水分子 water molecule 來舉例
- 他包含了 2 個 hydrogen atoms 和 1 個 oxygen atom
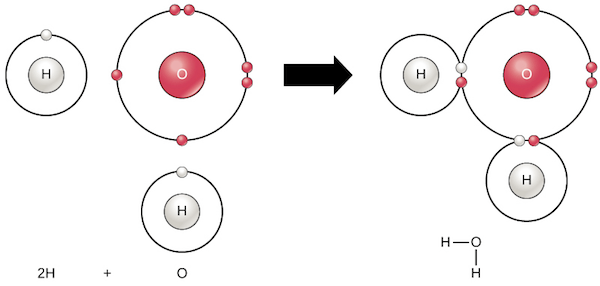
- Shared electron 將會在 H 和 O 之間游移
- 幫助 H 和 O 各別達到 complete valence shell (2 and 8 electrons)
Polar Covalent Bond
- 如果當中某個 shared electron 特別喜歡移動到某個 atom 時候
- 這個 bond 就是 polar covalent bond
- 也因為 electron 特別待在某一邊的關係,atoms 就會分別出現些微的正負電極
- slightly positive and slightly negative charge
- 在 water molecule 中就有這個現象
- 因為 oxygen 比 hydrogen 更加有 electronegative
- electronegative 越大代表越會吸引 electron
- 所以 electron 比較會待在 oxygen 周圍
- 使得 oxygen 有 slightly negative charge (high electron density)
- 而 hydrogens 則是 slightly positive charge (low electron density)
- 因為 oxygen 比 hydrogen 更加有 electronegative
- 總而言之,當兩個 atom bond 在一起時
- 較高 electronegative 的 atom 會試圖 "hog" shared electrons
- 較高者會得到些微的負電極
- 並且讓 covalent bond 呈現 polar 或 nonpolar 情況
Nonpolar Covalent Bond
- 當兩個 atom 間的 shared electrons 平均存在周圍是就是 nonpolar covalent bond 啦 !
- 例如氧分子 molecular oxygen
- oxygen atoms 互相分享最外層不足的兩個 electrons
- 例如甲烷 methane
- carbon atom 將自己的 4 個 electrons 分享給四個 hydrogen atoms
- 4 hydrogen atoms 也分享自己的 electron 來填滿 carbon atom
- 例如氧分子 molecular oxygen

Electronegativity and Bonding
- Covalent & ionic bonds 都是常見非常 strong 的 bonds
- 但生活中 (biology) 還有許多不同的 temporary bonds (weak)
- 沒有這些 bonds 就沒有生命
- 例如 hydrogen bonds 穩定 proteins 或 DNA 架構,幫助 cell 組成
Hydrogen bonds
- 在一些包含 hydrogen 的 polar covalent bond 中
- hydrogen 通常會帶有些微正極
- 因為 electron 會被別的 atom 吸引 (e.g., O-H bonds)
- 帶有些微正極的 hydrogen 就容易被帶有負極的鄰居吸引
- 這個現象就是 hydrogen bond
- 這個現象在 water molecules 中常見
- 單個 hydrogen bond 可能非常脆弱,但多個結合在一起就能非常堅固
London dispersion forces
- London dispersion forces 一樣是非常 weak 的 bond
- 但他不只能作用在 atoms 間,也能作用在 molecules 間
- 因為 electron 是 constant 移動,所以有時會結在一群
- 造成某一方 atom/molecule 變為 partial negative charge,另一方則相反
- 此時的些微正負極就讓兩邊吸引在一起
Bond in cell
- Strong 和 weak bonds 都會是 cell 中非常重要的角色,舉例來說
- Strong covalent bonds 幫助建立 strand of DNA
- Weaker hydrogen bonds 幫助建立 two strands of the DNA double helix
Chemical reactions
- 組成身體的分子 molecules 其實就是各種 atom 透過 chemical bonds 結合而成
- 試著將各種 atoms 用各種不同 chemical bonds 像積木一樣結合
- 不斷結合分開一個個 chemical bonds 的過程就稱作 chemical reaction
- 要參加 chemical reaction 的物質稱作 reactants
- 產生的產物就稱作 products (compound)
- 通常一般的 chemical reaction 是不容易被逆轉回來的
- 以下舉例一個 hydrogen peroxide 被拆成 2 個 water molecules 和 1 個 molecular oxygen 的 chemical reaction
注意水和過氧化氫的前面都有一個 2 他們是 coefficients
- 告訴我們有多少 molecules 參與在 reaction 讓整個反應平衡
- Balance : 等式兩邊的 atoms 數目一樣
- equation of reaction must be balanced 來達到質量守恆定律 (law of conservation of matter)
- 表示 reaction 中沒有任何 atom 消失或增加
- 告訴我們有多少 molecules 參與在 reaction 讓整個反應平衡
另外一個有趣例子是水分子的形成
- 太空梭前方的 tank 就是包含大量 liquid hydrogen & liquid oxygen
- 作用後產生大量能量,成為後方推進的動力
Reversibility and equilibrium
- 有些 reaction 是 irreversible 有些則是 reversible
- reactants 轉換成 products 是 forward reaction
- products 變回 reactants 則是 back reaction
- 在 reversible reaction 中
- 通常 back and forth reaction 會同時作用
- products 和 reactants 會試著達到一個最終平衡,稱為 equilibrium
- 在 equilibrium 的狀態時,還是會繼續作用下去,但兩者的平衡點再也不會改變
- 以下是一個 reversible 的在人體血液中的實例
- excess hydrogen ions 會和 bicarbonate ions 反應合成出 carbonic acid
- 如果有一些 carbonic acid 加入,那就會馬上轉換為 bicarbonate 和 hydrogen ions 來得到 equilibrium
- 這個反應其實就是我們人體保持 blood pH stable 的關鍵